Biohaven inscribe al primer paciente en un ensayo clínico de ataxia espinocerebelosa en fase 3 de troriluzol
Fuente, 14 de marzo de 2019
La compañía anuncia datos ampliados del estudio de extensión a largo plazo de troriluzol Fase IIb / III comparado con la cohorte de historia natural combinada
Las ataxias espinocerebelosas hereditarias son trastornos neurodegenerativos raros y potencialmente fatales que afectan al cerebelo. Se caracterizan clínicamente por síntomas de ataxia progresiva, que incluyen dificultades con el equilibrio, el habla y la coordinación, y se atribuyen a diversas mutaciones genéticas autosómicas dominantes. Actualmente, no hay tratamientos aprobados por la FDA y no hay cura para SCA.
Melissa Wolfe Beiner , MD, Directora de Investigación y Desarrollo y Líder Médico para el programa de desarrollo de Ataxia en Biohaven comentó: «Biohaven ha trabajado en estrecha colaboración con los principales centros académicos y clínicos para avanzar en este ensayo de Fase 3 de troriluzol en esta área de alta necesidad insatisfecha». El Dr. Wolfe Beiner agregó: «En base a los aprendizajes de nuestro ensayo clínico de Fase 2b / 3 anterior, hemos enriquecido este ensayo con genotipos específicos, extendimos el período de tratamiento de este ensayo a un año, implementamos el uso de una escala SARA modificada y aumentamos la dosis de troriluzol a 200 mg». Creemos que estos cambios pueden mejorar la capacidad del ensayo para evaluar con mayor precisión el beneficio del troriluzol en la reducción de la progresión de la enfermedad en pacientes con SCA».
Biohaven espera inscribir a aproximadamente 230 pacientes en este ensayo aleatorizado, doble ciego, controlado con placebo en aproximadamente 22 sitios en los Estados Unidos . Los investigadores evaluarán la eficacia y la seguridad del troriluzol durante 48 semanas en pacientes con un diagnóstico de SCA Tipos 1, 2, 3, 6, 7, 8 y 10. La medida de resultado primaria es el cambio en la puntuación de un paciente en el Funcional Modificado Escala para la evaluación y calificación de la ataxia, una escala diseñada para evaluar la gravedad de los síntomas en pacientes con SCA. Se pueden encontrar detalles adicionales sobre la prueba [NCT03701399] en www.clinicaltrials.gov .
Jeremy Schmahmann , MD, Profesor de Neurología en la Escuela de Medicina de Harvard y Director Fundador de la Unidad de Ataxia en el Hospital General de Massachusetts (MGH), agregó: «Estamos encantados de asociarnos con Biohaven y sus colegas de todo el país en este emocionante proyecto. Esperamos que «este ensayo proporcionará la primera evidencia convincente de un medicamento con potencial para mejorar la vida de nuestros pacientes con SCA».
Análisis ampliado del ensayo clínico BHV4157-201 de SCA y una cohorte de historia natural combinada
Biohaven también anunció los resultados de un análisis post-hoc de pacientes inscritos en la fase de aleatorización a corto plazo y de extensión a largo plazo del Estudio BHV4157-201 [NCT02960893], un ensayo controlado aleatorio de Fase 2b / 3 inicial en pacientes con SCA. , en comparación con los pacientes seleccionados de una cohorte de historia natural de pacientes con SCA que se compararon en múltiples criterios de elegibilidad.
El criterio de valoración principal de eficacia para este análisis fue el cambio desde el inicio en la Escala para la Evaluación y Calificación de Ataxia (SARA), puntuación total después de 48 semanas de seguimiento. Los pacientes de la cohorte de historia natural se compararon con los pacientes del ensayo BHV4157-201 en SCA Genotype (SCA1, SCA2, SCA3, SCA6), edad al inicio del estudio (18 a 75 años de edad), sexo, SARA Puntuación inicial (≥ 8) y ≤ 30), y la puntuación inicial en el elemento de la marcha de la SARA ≥ 2.
Según el análisis de covarianza (ANCOVA), los cambios medios mínimos cuadrados después de un año fueron de -0.34 puntos (que representan una mejora numérica con un intervalo de confianza del 95% de -0.94 a 0.26) para 81 pacientes tratados con troriluzol versus +1.07 puntos (que representan una disminución numérica con un intervalo de confianza del 95% de 0,56 a 1,58) para 112 pacientes de cohorte de historia natural (la puntuación creciente indica un empeoramiento del estado de la enfermedad). La diferencia de la media de LS entre cohortes fue de -1.41 puntos (intervalo de confianza del 95% de -2.22 a -0.60), lo que sugiere beneficios terapéuticos del troriluzol (p = 0.0007).
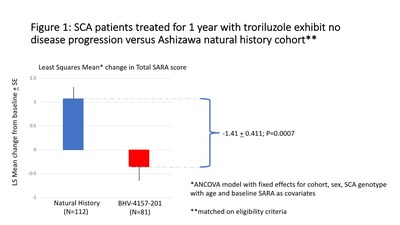
La Figura 1 muestra una atenuación de la progresión de la enfermedad en un año entre los pacientes tratados con troriluzol versus la cohorte de historia natural en este análisis post hoc. La diferencia en las tasas de progresión (-1.41) excede la diferencia mínima clínicamente importante de 1.0 en el puntaje total de SARA en un año.
La cohorte de historia natural se derivó de un estudio prospectivo, realizado por el Consorcio de Investigación Clínica para las Ataxias Espinocerebelosas (Ashizawa, et al. 2013) y se reclutó en 12 clínicas de ataxia en todo Estados Unidos . Los pacientes en el Estudio BHV4157-201 fueron tratados con 140 mg de troriluzol administrados diariamente durante un año.
Gil L’Italien, Ph.D., Jefe de Economía de la Salud Global e Investigación de Resultados en Biohaven declaró: «Los hallazgos del análisis de fase de extensión post-hoc de troriluzol en comparación con pacientes no tratados de la cohorte de historia natural son alentadores y proporcionan más información. apoyo para el beneficio terapéutico potencial a largo plazo del troriluzol en pacientes con SCA. Estamos encantados de haber inscrito al primer paciente en el estudio de Fase 3, que probará más a fondo el potencial terapéutico del troriluzol en el tratamiento del SCA en el transcurso de uno año.»
Acerca de Troriluzole
El troriluzol es un profármaco de tercera generación y una nueva entidad química que modula el glutamato, el neurotransmisor excitador más abundante en el cuerpo humano. El principal modo de acción del troriluzol es reducir los niveles sinápticos de glutamato. El troriluzol aumenta la captación de glutamato de la sinapsis al aumentar la expresión y la función de los transportadores de aminoácidos excitadores (es decir, EAAT2) ubicados en las células gliales que desempeñan un papel clave en la eliminación del glutamato de la sinapsis. Puede encontrar más información sobre trorilzuole en el sitio web de la compañía: https://www.biohavenpharma.com/science-pipeline/glutamate/troriluzole
Acerca de Biohaven
Biohaven es una compañía biofarmacéutica en etapa clínica con una cartera de productos innovadores, en etapa avanzada, que se enfocan en enfermedades neurológicas, incluidos los trastornos raros. Biohaven ha combinado el desarrollo interno y la investigación con propiedad intelectual con licencia de empresas e instituciones, entre ellas, la empresa Bristol-Myers Squibb, AstraZeneca AB, la Universidad de Yale , Catalent, Rutgers , ALS Biopharma LLC y el Hospital General de Massachusetts. Actualmente, los programas de desarrollo líder de Biohaven incluyen múltiples compuestos a través de su antagonista del receptor de CGRP, modulación del glutamato y plataformas inhibidoras de la mieloperoxidasa. Las acciones ordinarias de Biohaven se cotizan en la Bolsa de Nueva York y se negocian con el símbolo BHVN. Más información sobre Biohaven está disponible enwww.biohavenpharma.com .
Declaraciones a futuro
Este comunicado de prensa incluye declaraciones prospectivas en el sentido de la Ley de Reforma de Litigios de Valores Privados de 1995. Estas declaraciones prospectivas implican riesgos e incertidumbres sustanciales, incluidas declaraciones basadas en las expectativas y suposiciones actuales de la administración de la Compañía. Todas las declaraciones, aparte de las declaraciones de hechos históricos, incluidas en este comunicado de prensa, incluida la inscripción esperada para el ensayo de troriluzol en la Fase 3 de la Compañía, los resultados potenciales del ensayo de troriluzol en Fase 3 de la Compañía, los beneficios de los cambios en el diseño de ensayo para el ensayo clínico de Fase 3 comparado con ensayos anteriores, el potencial para que el ensayo de Fase 3 sea un ensayo fundamental, El papel del glutamato en SCA y los posibles beneficios del troriluzol en comparación con el estándar de atención actual para los pacientes con SCA, son declaraciones a futuro.
El uso de ciertas palabras, incluyendo «creer» y «voluntad» y expresiones similares están destinadas a identificar declaraciones a futuro. Es posible que la Compañía no logre realmente los planes y objetivos revelados en las declaraciones a futuro y usted no debe depositar una confianza indebida en las declaraciones a futuro de la Compañía. Varios factores importantes podrían causar que los resultados o eventos reales difieran materialmente de aquellos que pueden expresarse o implicarse en nuestras declaraciones prospectivas, incluidas las incertidumbres relacionadas con el futuro éxito clínico del troriluzol.28 de febrero de 2019 . Las declaraciones prospectivas se realizan a partir de esta fecha y la Compañía no asume ninguna obligación de actualizar ninguna declaración prospectiva, ya sea como resultado de nueva información, eventos futuros o de otro tipo, excepto que lo exija la ley.
Para obtener más información, comuníquese con el Dr. Vlad Coric , Director Ejecutivo de Biohaven en Vlad.Coric@biohavenpharma.com










Me gustaría participar que tendría que hacer
Buenas tardes María Denisse!
Biohaven espera inscribir a aproximadamente 230 pacientes en este ensayo aleatorizado, doble ciego, controlado con placebo en aproximadamente 22 sitios en los Estados Unidos.
Aún está en proceso de inscripción de pacientes.
Por lo que no es fácil participar en el ensayo.
Tan pronto como se publiquen los resultados de esta fase del ensayo, los haremos públicos.
No dejes de leernos, un saludo.
Soy Denisse de Palma de Mallorca España y querría saber si ese medicamento va a llegar a España o cuáles son los pasos a seguir para que llegue tengo ataxia de tipo 3 desde los 22 años y tengo 37 años y no creo que aguante mucho me gustaría saber si ha llegado o va a llegar a España espero ansiosa una respuesta gracias
Buenas tardes María Denisse!
Este ensayo aún se encuentra en fase de reclutamiento de personas.
La fecha estimada de finalización del estudio : 31 de octubre de 2020.
Tan pronto como existan resultados del mismo, los publicaremos.
Gracias por leernos y feliz año!
Buenas tardes. Vivimos en Bogotá-Colombia. Mi hermano padece de ataxia cerebelosa de presentación tardía, la cual viene padeciendo desde hace dos años padece de sindrome vertiginoso vestibular izquierdo, hipotensión ortostática y parkisonismo hemiferio izquierdo. Le agradezco su colaboración. En la actualidad presenta dificultad para caminar, hace uso de silla ruedas, tiene dificultad para hablar, su movilidad es muy limitada.
Querida Martha!
En la federación de ataxias de España, somos pacientes de ataxia y familiares.
No podemos ofrecer asesoramiento médico.
Para ello debe ser su neurólogo o especialista quien le oriente sobre estos temas tan delicados.
Tal vez, podrías contarctar con la federación colombiana de enfermedades raras: Correo electronico info@fecoer.org
donde es miembro la asociación de ataxias
https://www.fecoer.org/asociacion-colombiana-de-ataxia-hereditaria-acat/
en este link puedes encontrar la información al respecto, desconocemos si sigue activa o no.
Un saludo y animo!
Soy Esteban de 56 años con ataxia cerebelosa,me han echo análisis de Friedrich y sca del uno al diez dando negativas por eso estoy en estudio.
Dios los bendiga soy mamá de Isabella de 3 años..con Ataxia cerebelosa..hereditaria.. esta enfermedad se llevó a mi hermana a los 5 años…Dios quiera que pronto se pueda poner en practica….es una enfermedad devastadora…Dios guíe su sabiduria…besos
Encuentro tan valioso como tratan de obtener avances para esta enfermedad, por mi parte mi familia tengo a mi mamá con la ataxia, mi hermana mayor (fallecida) tenía microcefalia, luego mi otro hermano tiene parálisis cerebral y mi otro hermano menor está diagnosticado con la ataxia que ha sido muy agresiva con el, además tengo un tio materno también con esta enfermedad y su hijo ya ahora adulto comenzó con claros síntomas de la ataxia, también hace meses conocí una tía por parte materna igual que también esta diagnosticada de ataxia, acá en punta arenas (Chile) ha sido terrible sobrellevar esta vida. Saludos y de verdad espero algún día encontrar una mejora! Exito! Exito!
Muchas gracias Makarena!
Esperamos que alguno de los ensayos que se llevan a cabo sean fructíferos y arrojen resultados positivos.
Seguiremos informando.
Gracias por leernos, un saludo y ánimo para sobrellevar esa situación.
Soy de Republica Dominicana.
Estoy padeciendo una Ataxia la cual me a impedido la locomoción, equilibrio y otras cosas.
Buenas tardes Alberto!
Lamentablemente no podemos proporcionar asesoramiento médico.
Póngase en manos de su profesional de la salud o un buen neurólogo que pueda orientarle mejor.
Un saludo y gracias por leernos.
Hola soy gloria y tengo Ataxia cerebelos adquirida estoy impedida en este momento
Hola mí esposo tiene 52 años y tiene ataxia espunocerebelosa 3 y su hermana 56 años misma patología
Buenas noches Silvia!
Esperemos que ese ensayo arroje resultados positivos.
Gracias por leernos y un saludo,
Mi hija de 4 años tiene una mutación en el gen ITPR1 q está asociado a una Ataxia Espinocerebelosa SCA 29.
Esa investigación nos sería de ayuda? Actualmente está tomando Tanganil q le recetaron en San Joan De Deu la doctora O’Callaghan
Buenas tardes Sonia!
Nosotros solo facilitamos las noticias relevantes sobre cualquier tipo de ataxia haciendo de puente entre la información y el paciente.
Lamentablemente no podemos ni debemos proporcionar asesoramiento médico.
La Dra. O’Callaghan a quien tenemos el gusto de conocer ya que ha participado como ponente en nuestras jornadas científicas y de convivencia sería la persona adecuada para facilitar todo tipo de información sobre el ensayo y sus posibilidades.
Gracias por leernos, ánimo y un saludo,
Hola Sonia,un gusto,te cuento que mi hija acá de ser diagnosticada con ataxia 29,solo tiene 19 meses, quisiera conocer tu experiencia,mil gracias